Que sait-on de Lulu et Nana, les deux premiers bébés génétiquement modifiés au monde ?
Le scientifique chinois He Jiankui a affirmé mercredi 28 novembre avoir recouru à une technologie appelée Crispr-Cas9 pour modifier les gènes des embryons de deux jumelles qui sont nées ce mois-ci. Il s'agirait d'une avancée majeure et d'une première mondiale. L'annonce a cependant provoqué un tollé, pour des raisons scientifiques autant qu'éthiques.


Le lundi 26 novembre, une équipe chinoise basée à Shenzen et dirigée par le Dr He Jiankui a annoncé la naissance de Lulu et Nana, les deux premiers bébés génétiquement modifiés à l’aide de la technologie CRISPR. Il a présenté brièvement ses travaux le mercredi 28 novembre au deuxième sommet international sur l’édition du génome humain qui a eu lieu à Hongkong. Même si les informations restent fragmentaires et attendent la publication officielle d’un article scientifique évalué par les pairs, on en sait aujourd’hui un peu plus sur ces travaux sans précédent et très controversés.
En 2015, une équipe chinoise a testé l’efficacité et la spécificité de l’édition du génome par CRISPR dans des embryons humains non-viables. Cette première étude a révélé les limites actuelles de la technique dans la mesure où de nombreux embryons présentaient une structure mosaïque (les cellules du même embryon ne possèdent pas toutes la modification).
Puis en juillet 2017, l’équipe du Dr Mitalipov annonce avoir modifié avec succès des embryons humains pour corriger une mutation du gène MYBPC3 responsable de maladies du muscle cardiaque, les cardiomyopathies hypertrophiques. En accord avec la limite de 14 jours imposée à la recherche sur l’embryon humain, aucun embryon n’avait été autorisé à se développer plus que quelques jours et tous ont ensuite été détruits.
Ce qui aurait été fait par le Dr He Jiankui
Le Dr He Jiankui est allé beaucoup plus loin. Le choix s’est porté sur le gène CCR5, non pas pour corriger une mutation, mais pour créer un variant naturel appelé CCR5 Δ32, ce qui empêche le virus de l’immunodéficience humaine (VIH) d’entrer dans les lymphocytes CD4 et donc de les infecter. C’est cette modification que les chercheurs ont mimée dans le génome des embryons pour les protéger d’une éventuelle infection par le VIH (les pères des huit couples impliqués dans l’étude sont tous séropositifs).

L’ARN guide sg4, qui contient l’information sur la séquence du génome à reconnaître, ciblant ∆32 CCR5 a d’abord été testé chez la souris, le singe et dans des lignées de cellules humaines en culture (HEK293) pour vérifier son efficacité et l’absence d’effet hors cible (off-target), c’est-à-dire une modification génétique à un endroit non souhaité. L’ARN guide a aussi été testé sur des embryons triploïdes (contenant 3 jeux complets de chromosomes) non-viables.
Au total, 31 embryons ont été obtenus par fécondation in vitro ; 9 n’ont pas été modifiés (allèle wild-type (WT), c’est-à-dire allèle sauvage d’origine) ; 22 (70 %) ont été édités et 2 embryons portant la version inopérante du gène CCR5 ont été réimplantés. Lors du sommet international sur l’édition du génome humain, le Dr He Jiankui a même évoqué l’existence d’une autre grossesse en cours et donc d’un 3e bébé.
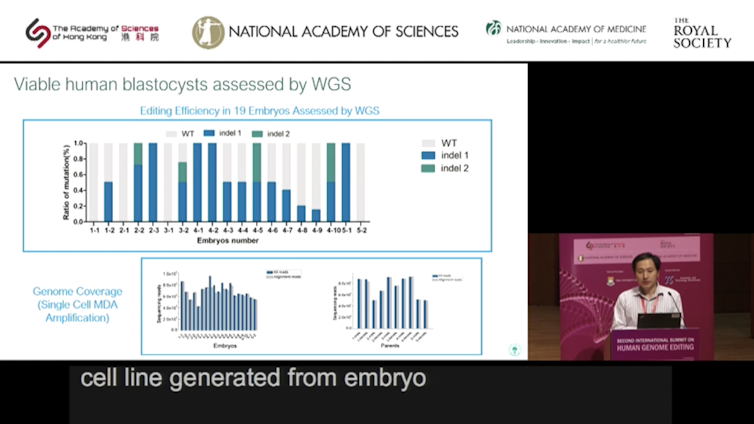
Le choix s’est porté sur l’embryon 1 pour Lulu et l’embryon 2 pour Nana. Chaque enfant hérite de deux copies (allèles) de chaque gène, une copie héritée de la mère et une copie héritée du père. Dans le cas de Lulu, une copie de CCR5 contient une insertion d’une paire de bases (+1 bp) et l’autre copie contient une délétion de 4 paires de bases (-4 bp). Elle est donc hétérozygote -4 bp/+1 bp. Nana est aussi hétérozygote car une seule copie de CCR5 a été modifiée et contient une délétion de 15 bp (-15 bp/WT).
Quand on regarde de près les données fournies par le Dr He Jiankui, c’est très inquiétant. Les séquences ne sont pas homogènes et suggèrent la présence d’un allèle sauvage toujours présent (chevauchement de 2 séquences différentes entourées en rouge dans la diapositive ci-dessous). L’existence d’un mosaïcisme cellulaire, qui fait que certaines cellules sont modifiées et d’autres non, est donc fort probable, ce qui pourrait être désastreux.
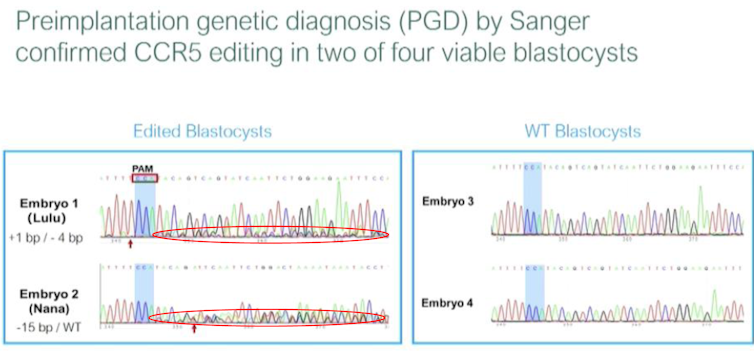
La délétion de 15 bp est aussi très problématique puisqu’elle ne correspond pas à CCR5 Δ32. Cette délétion enlève 5 acides aminés de CCR5, ce qui peut toujours conduire à une protéine fonctionnelle et donc à des cellules toujours sensibles à l’infection par le VIH.
Enfin, le diagnostic génétique préimplantatoire (DPI ou PGD pour Preimplantation Genetic Diagnosis) de ces deux embryons indique l’existence d’un effet hors-cible (off-target) potentiel pour l’embryon 1 qui se trouve dans une région non codante du génome à 279 kb du premier gène répertorié dans cette région. L’équipe du Dr He Jiankui a considéré que cela était sans risque et a donc décidé de procéder à la réimplantation avec l’accord des parents.

Après la naissance, ce hors-cible potentiel n’a pas été retrouvé dans le placenta ou le sang du cordon ombilical.

L’ensemble de la communauté a condamné à juste titre très fermement ces travaux. En dehors même des problèmes éthiques que posent de telles recherches, il faut bien rappeler que la technique CRISPR, certes très efficace, n’est pas encore totalement fiable. Les effets hors-cibles et le risque de mosaïcisme des embryons sont loin d’être aujourd’hui résolus.
De plus, ces embryons étaient sains et ces travaux ne sont ni scientifiquement ni médicalement justifiés. La modification des cellules germinales (visant la reproduction et donc la transmission des caractères à la génération suivante) reste aujourd’hui problématique.
Des questions éthiques
Toute modification implique des considérations éthiques qui exigent une parfaite maîtrise des conséquences avant toute utilisation. L’obtention du consentement des parents concernés a-t-elle été faite sérieusement ? Les parents ont-ils été bien informés des risques encourus et des conséquences qu’une telle expérience pouvait engendrer ? Un comité d’éthique a-t-il été consulté ? Les fillettes apprendront-elles un jour que leur génome a été modifié ?
Beaucoup de questions restent aujourd’hui sans réponse. Dans l’état actuel des connaissances et à la lecture des données expérimentales disponibles, sans parler des multiples questions éthiques, cette première tentative de modifier génétiquement des embryons est totalement irresponsable et injustifiée. Jamais ces embryons n’auraient dû être réimplantés ni les grossesses menées à terme.
Je remercie Gaëtan Burgio pour la relecture critique de cet article et pour son analyse des données expérimentales disponibles qui a orienté et inspiré mes propres réflexions.![]()
Alexis Verger, chargé de Recherche au CNRS, UMR 8576 UGSF, Université de Lille
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.



Commentaires
Connectez-vous à votre compte franceinfo pour participer à la conversation.