Comment le vaccin AstraZeneca, bientôt utilisé en France, a-t-il été mis au point ?
Deux chercheurs de l'université d'Oxford (Royaume-Uni) ayant participé au développement du vaccin du laboratoire AstraZeneca en expliquent la genèse.


Il devrait arriver en France dès samedi 6 février. La première livraison de ce vaccin AstraZeneca, troisième à être autorisé dans le pays pour lutter contre le Covid-19, "sera affectée aux établissements de santé, pour protéger les professionnels de santé, hospitaliers et de ville", a annoncé le Premier ministre, jeudi 4 février. Selon Jean Castex, l'arrivée de ce troisième vaccin devrait permettre d'accélérer le rythme de la vaccination. Dans son avis, rendu public mardi, la Haute Autorité de santé (HAS) a détaillé la stratégie vaccinale pour le AstraZeneca: il n'est pas recommandé pour les plus de 65 ans, faute de données actuellement disponibles sur son efficacité dans cette classe d'âge. Dans The Conversation, deux chercheurs de l'université d'Oxford ayant participé à son développement expliquent comment il a été mis au point.
La pandémie de Covid-19 a débuté il y a un an et nous disposons déjà de plusieurs vaccins pour lutter contre cette maladie, dont celui mis au point par l'équipe dont nous faisons partie à l'université d'Oxford.
Avec notre partenaire, le laboratoire AstraZeneca, nous avons soumis des données provisoires d'efficacité et des données de sécurité pour le vaccin aux autorités de réglementation partout dans le monde, afin d'obtenir une évaluation et une approbation indépendantes. À ce jour, le vaccin a été approuvé pour une utilisation d'urgence au Royaume-Uni, en Inde, au Maroc, en Argentine et au Salvador.
Il s'agit non seulement d'une excellente nouvelle pour anticiper un retour à la normale, mais aussi d'un véritable exploit scientifique. En général, il faut des décennies pour mettre au point un vaccin. Or, voilà qu'après seulement 12 mois, plusieurs vaccins contre le Covid-19 sont déjà sur le marché. Voici comment nous sommes parvenus à mettre au point le vaccin d'Oxford dans de tels délais.
Une longueur d'avance
Notre vaccin fonctionne en acheminant la séquence génétique de la protéine de pointe (protéine "Spike") du Sars-CoV-2 aux cellules de l'organisme. Rappelons que les protéines de pointe sont les structures qui "couronnent" la surface du coronavirus, lui donnant l'apparence caractéristique dont il tire son nom. Les cellules de l'organisme vacciné lisent ce code génétique et commencent à produire des copies de la protéine de pointe. Le système immunitaire met alors en place une réponse contre ces protéines étrangères et la garde en mémoire. Cela signifie que si le Sars-CoV-2 pénètre plus tard dans l'organisme, ses protéines de pointe seront détectées par le système immunitaire, qui s'activera pour détruire le coronavirus.
Cela peut sembler compliqué, mais lorsque la pandémie est arrivée, nous avions une longueur d'avance, car nous avions déjà mis au point une méthode d'administration – ou plateforme – pour notre vaccin et nous l'avions testé pour d'autres maladies pendant près de dix ans. Connue sous le nom de ChAdOx1, cette plateforme a été créée en modifiant un adénovirus inoffensif qui provoque le rhume chez les chimpanzés.
Le ChAdOx1 a été choisi car il peut générer une forte réponse immunitaire. En outre, ce n'est pas un virus qui se réplique, donc il ne peut pas provoquer d'infection. Il avait déjà été utilisé en toute sécurité sur des milliers de sujets lors d'essais cliniques de vaccins contre d'autres maladies, notamment le syndrome respiratoire du Moyen-Orient (Mers), causé par un autre type de coronavirus.
Nos recherches en cours sur le ChAdOx1 s'inscrivent dans le cadre de la préparation à la "maladie X". L'expression "maladie X" est utilisée pour désigner la prochaine épidémie grave, qui pourrait être causée par un agent pathogène encore inconnu des scientifiques. C'est ce qui s'est produit avec le coronavirus Sars-CoV-2 ; le Covid-19 figure désormais aux côtés de sept autres maladies et de la "maladie X" désignées par l'Organisation mondiale de la santé (OMS) comme prioritaires pour la recherche, en raison du risque qu'elles représentent pour la santé publique.

Une fois que les chercheurs en Chine ont publié la séquence génétique du coronavirus, nous avons pu produire rapidement notre vaccin en combinant le vecteur ChAdOx1 avec la séquence génétique de la protéine de pointe du Sars-CoV-2.
La préparation à la maladie X a finalement permis à notre équipe de passer directement aux essais de notre vaccin sur des animaux dès le début de 2020, puis de combiner les données de ces essais avec les données déjà recueillies lors d'essais antérieurs utilisant le ChAdOx1, pour prouver l'efficacité dudit vaccin.
Rendre les essais sur l'homme plus efficaces
Avec les données issues de nos études sur les animaux en notre possession, nous étions prêts à passer aux essais cliniques – qui consistent essentiellement en une série de tests visant à montrer qu'un traitement est sûr et efficace chez l'être humain.
Les essais de vaccins sont généralement divisés en trois phases. La phase 1 évalue l'innocuité (sécurité) d'un vaccin et sa tolérance, ainsi que la réponse immunitaire. La phase 2 implique des essais sur un groupe de personnes plus nombreux et plus diversifié et sert à déterminer la dose et le calendrier optimaux.
La phase 3 vise ensuite à tester la sécurité et l'efficacité d'un vaccin sur un groupe important de personnes, souvent dans plusieurs endroits. Cette évaluation se fait généralement en surveillant le nombre de cas d'infection observés dans un groupe qui reçoit le vaccin par rapport à un groupe qui ne le reçoit pas.
Habituellement, les différentes phases d'essai sont menées séparément, en prenant du temps entre chacune pour préparer les protocoles et les demandes de financement, puis pour obtenir les approbations éthiques et réglementaires. Mais pour notre vaccin, nous avons entrepris des essais combinés de phase 1 et 2 et de phase 2 et 3 afin d'accélérer le processus de développement.
Cette façon de procéder ne signifie pas que nous sautons des étapes, mais plutôt que nous lançons l'étape suivante dès que nous avons recueilli suffisamment de données sur la phase précédente, après que ces données ont été examinées par un comité indépendant.
Lentement mais sûrement
Certaines personnes mettent en doute la sécurité du vaccin en raison de la rapidité de sa mise au point. Cependant, l'essai du vaccin contre le Covid-19 à Oxford – qui est toujours en cours – fait l'objet de la même attention que les autres essais de vaccins.
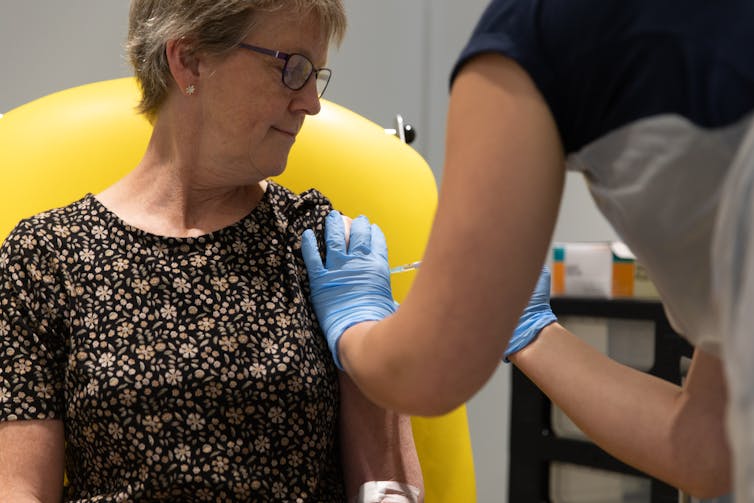
Tous les participants sont étroitement surveillés, et toute personne développant une maladie grave ou devant être hospitalisée, quelle qu'en soit la raison – même une jambe cassée – fait l'objet d'un rapport. Si l'un de ces événements est considéré comme pouvant être lié au vaccin, une évaluation indépendante est effectuée pour étudier soigneusement les données médicales. Pendant cette période, la vaccination est suspendue. Elle est relancée une fois que l'évaluation est terminée et que l'on considère qu'il est possible de continuer en toute sécurité.
Effectuer des essais dans différentes populations est crucial, car tout vaccin contre le Covid-19 est susceptible d'être distribué auprès d'un grand nombre de personnes partout dans le monde. À la fin des essais que nous menons, 24 000 personnes auront été inclues, dans quatre pays, et 30 000 autres auront participé aux essais menés par nos partenaires. Au total, le vaccin aura été testé sur près de cinq fois plus de volontaires que ce qui est habituellement requis pour l'homologation d'un vaccin.![]()
Cet article est republié à partir de The Conversation sous licence Creative Commons. Il est signé Tonia Thomas, Vaccine Knowledge Project Manager, University of Oxford et Rachel Colin-Jones, Visiting Academic, Centre for Clinical Vaccinology and Tropical Medicine, University of Oxford. Lire l'article original.



Commentaires
Connectez-vous à votre compte franceinfo pour participer à la conversation.